人才强校 | 中国农大韩红兵副教授课题组在抗乳房炎基因工程山羊研究方面取得重大进展
中国农大新闻网讯 6月28日,中国农业大学韩红兵副教授课题组在国际知名杂志《eLife》上发表了研究论文《融合Toll样受体2-4基因工程山羊增强自噬依赖性金黄色葡萄球菌清除》(Domain fusion TLR2-4 enhances the autophagy-dependent clearance of Staphylococcus aureus in the genetic engineering goat)。该研究首次构建了融合TLR2-4受体基因,并研究其调控金黄色葡萄球菌异体自噬的分子网络。

金黄色葡萄球菌是引起动物乳房炎、肺炎、皮肤感染等疾病的重要病原菌之一,给家畜饲养管理与经济造成非常大的负担。目前以抗生素治疗为主要手段,但伴随抗生素的大量使用,金黄色葡萄球菌对药物产生抗性,进化出抗药性变异株,致使治疗效果不佳,另一方面抗生素残留,也带来畜产品的安全隐患。提高动物自身抗病能力,以抵抗病原菌是抗病育种发展的新方向。免疫调节及异体自噬是提高动物抗病能力的重要切入点,异体自噬是免疫细胞清除病原菌的有效途径。Toll样受体家族在免疫调节和自噬生物学过程中发挥关键作用,其中TLR2受体可以识别革兰氏阳性病原菌(包括金黄色葡萄球菌)激发免疫防御,但其需要与TLR1或TLR6形成异源二聚体,而TLR4识别革兰氏阴性病原菌,通过自身形成同源二聚体激活免疫反应与自噬。本研究利用TRL2胞外结构域识别金黄色葡萄球菌,TLR4跨膜和胞内结构域激活自噬的特征,以山羊为模型首次构建了TRL2和TLR4结构域融合蛋白,通过识别金黄色葡萄球菌,自身形成同源二聚体,激活细胞异体自噬,提高对金黄色葡萄球菌抗病能力。

融合蛋白TLR2-4构建,阳性体细胞筛选,基因工程山羊制备及异体自噬和金黄色葡萄球菌清除
本研究采用CRISPR/Cas9基因编辑系统介导的定点插入技术,将融合受体TLR2-4基因靶向整合到SETD5基因座上,并通过体细胞核移植技术,获得了TLR2-4基因工程山羊。分离培养血液来源巨噬细胞,进行体外金黄色葡萄球菌攻毒,发现免疫细胞异体自噬和细菌清除能力显著增加,进一步通过一系列转录组、信号通路分析等实验证实,TLR2-4主要通过MyD88和TRIF依赖的TAK1/TBK1-JNK/ERK, TBK1-TFEB-OPTN和cAMP-PKA-NF-κB-ATGs三条主要信号通路增强巨噬细胞异体自噬水平,实现金黄色葡萄球菌免疫防御。其中,cAMP-PKA-NF-κB-ATGs是新发现的自噬相关信号通路,而另外两条是内源TLR2和TLR4激活的信号通路。另外文中新发现JNK和ERK1/2抑制ATG5和ATG12表达,从而降低自噬水平(与先前文献报道结果不一致)。本研究一方面为抗乳房炎山羊新品种培育提供了育种新素材,另一方面也为研究病原菌异体自噬提供了动物模型和理论借鉴。同时,本工作申请了3项国家发明专利,其中1项基因编辑友好位点相关发明专利授权。
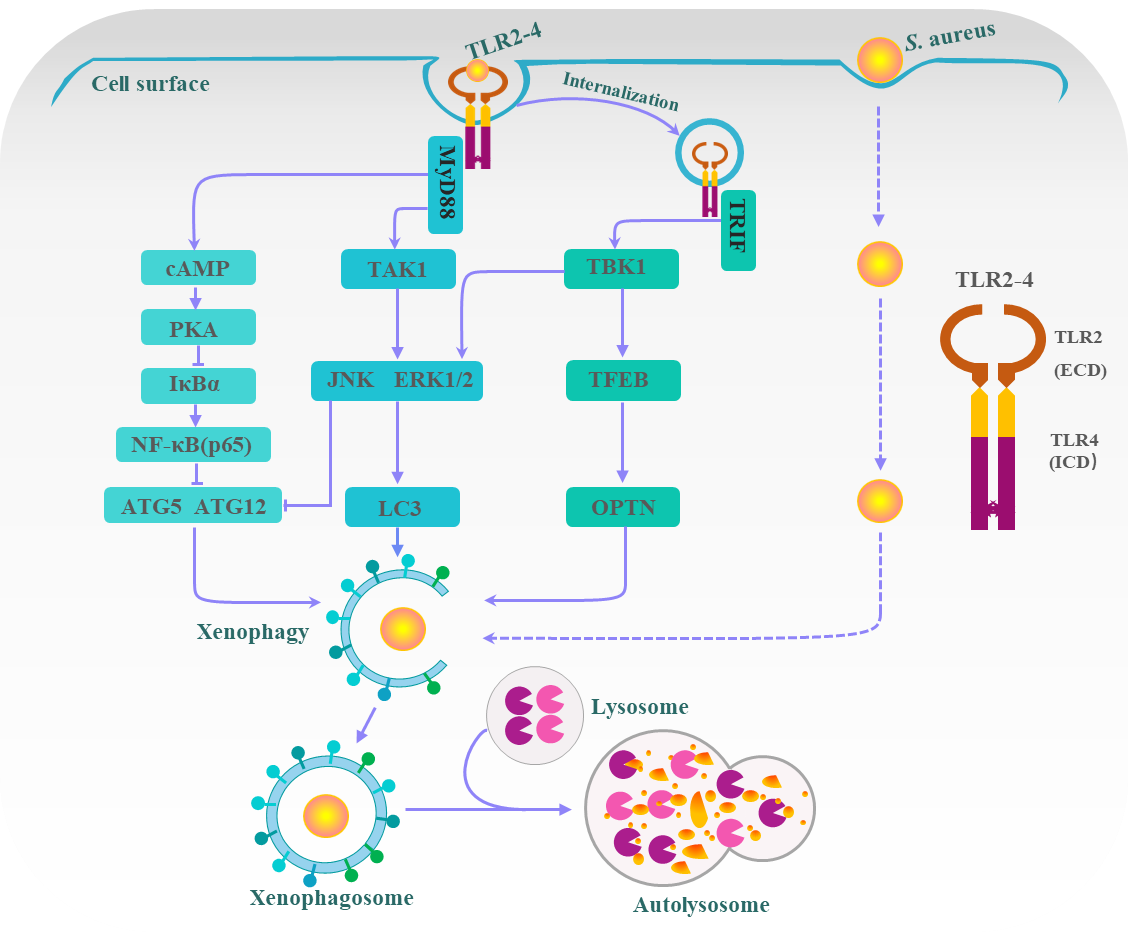
TLR2-4调控异体自噬的信号网络
中国农业大学为通讯单位,天津市农业科学院、广西大学、西北农林科技大学和四川农业大学参与完成本工作。中国农业大学动物科技学院毕业博士王梦瑶和硕士齐钰为本文第一作者,韩红兵副教授为本文通讯作者,连正兴教授给予了大力支持与帮助。
本研究获得了重大专项抗病转基因羊新品种培育课题资助。
原文链接:https://elifesciences.org/articles/78044
供稿:动物科技学院 韩红兵
供图:动物科技学院
编辑:李杨
责编:于哲
