12月12日,中国农业大学动物医学院兽医公共卫生安全全国重点实验室和农业农村部动物流行病学重点实验室杨汉春教授团队在《自噬》(Autophagy)上在线发表研究论文《塞内卡病毒A型通过2C蛋白与RNF185催化的K27链泛素化的TUFM直接相互作用诱导线粒体自噬促进病毒复制》(Senecavirus A induces mitophagy to promote self-replication through direct interaction of 2C protein with K27-linked ubiquitinated TUFM catalyzed by RNF185)。

论文对塞内卡病毒A型(SVA)感染诱导宿主细胞线粒体自噬的分子机制进行了研究,发现SVA的2C蛋白通过与线粒体TUFM蛋白直接相互作用而锚定在线粒体上,并在E3泛素连接酶RNF185催化下TUFM发生K27连接的泛素化修饰,进而被SQSTM1识别并结合,而SQSTM1又通过与LC3相互作用,将2C锚定的线粒体包裹进线粒体自噬体中,实现完全的线粒体自噬,借此促进SVA在宿主细胞中复制。研究结果丰富了对SVA致病机制的认知,也为基于调控宿主与病毒相互作用设计新型抗病毒策略提供了新思路和新靶标。
塞内卡病毒A型(Senecavirus A,SVA)是一种新发对猪致病的病原,可引起不同年龄段猪口、鼻及蹄部产生水疱、溃疡以及新生仔猪急性死亡,对全球养猪业造成了较大威胁。在分类上,SVA属于微RNA病毒科塞内卡病毒属,其基因组为单股正链RNA,全长约7.3kb,编码结构蛋白VP1、VP2、VP3和VP4以及非结构蛋白L、2A、2B、2C、3A、3B、3C和3D。作为猪的新发病原,SVA的致病机理和免疫调控机制等科学问题亟待解答,开展此类研究有助于创新SVA感染的防控策略,也为其他动物病原的研究提供参考。
作者利用透射电镜、激光共聚焦免疫荧光、Western blot和线粒体分离等技术证实,SVA感染能够诱导宿主细胞发生完全线粒体自噬(图1),并且SVA诱导线粒体自噬依赖于病毒复制。

图1. SVA感染诱导宿主细胞发生线粒体自噬现象
通过对SVA各蛋白进行异位表达,并利用Western blot和激光共聚焦免疫荧光等技术证实,SVA 2C蛋白能够独立诱导线粒体自噬。借助免疫共沉淀配合质谱鉴定发现,2C蛋白通过与线粒体蛋白质翻译延伸因子(TUFM)相互作用诱导线粒体自噬。通过构建2C和TUFM蛋白系列截短体并利用免疫共沉淀证实,2C蛋白第231‒321位氨基酸与TUFM蛋白第56‒252位氨基酸所在区域是两者互作的关键区域,其中TUFM蛋白第196和211位谷氨酸(E196和E211)是决定两者互作的关键位点(图2)。
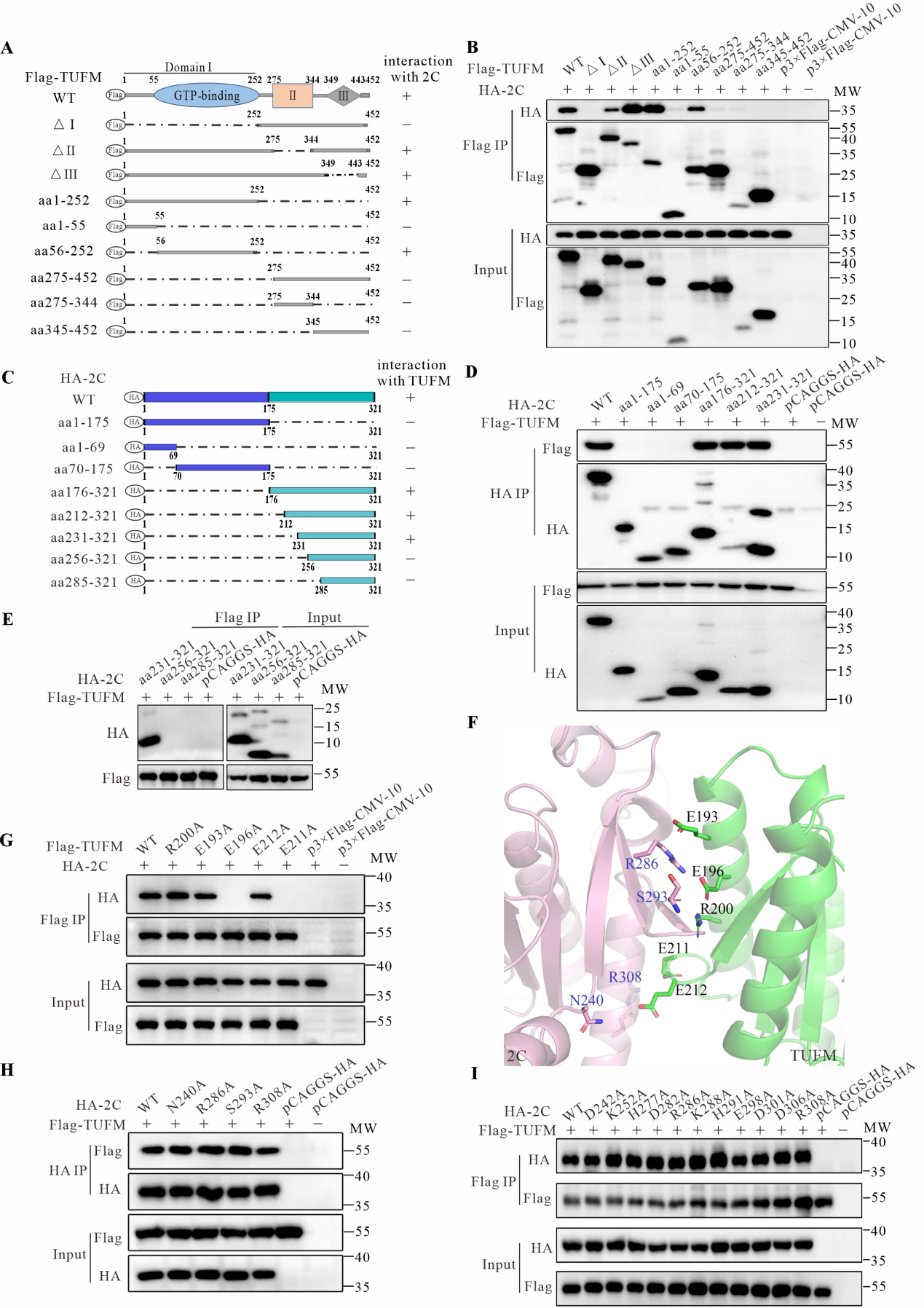
图2. SVA 2C蛋白与线粒体TUFM蛋白互作关键区域和位点的鉴定
通过构建携带不同标签的泛素和TUFM真核表达质粒,共转染细胞,借助免疫共沉淀发现TUFM在细胞内发生泛素化修饰,且SVA感染可显著增强TUFM泛素化水平,只有泛素化修饰的TUFM才能与p62发生互作,而p62又与LC3存在互作。以内源性TUFM为诱饵,利用免疫共沉淀配合质谱鉴定,证实RNF185是催化TUFM泛素化修饰的关键E3泛素连接酶。通过构建系列截短体和突变体发现,RNF185通过其TM1结构域与TUFM互作,催化TUFM发生K27链泛素化修饰(图3)。

图3. RNF185与TUFM互作关键区域以及TUFM泛素化修饰类型的鉴定
综上,该研究证实了SVA感染通过诱导宿主细胞发生线粒体自噬促进病毒复制,SVA 2C蛋白通过与RNF185催化的K27链泛素化的TUFM直接相互作用诱导线粒体自噬发生(图4)。该研究丰富了对SVA致病机制的认识,并为新型抗病毒策略设计提供了线索。
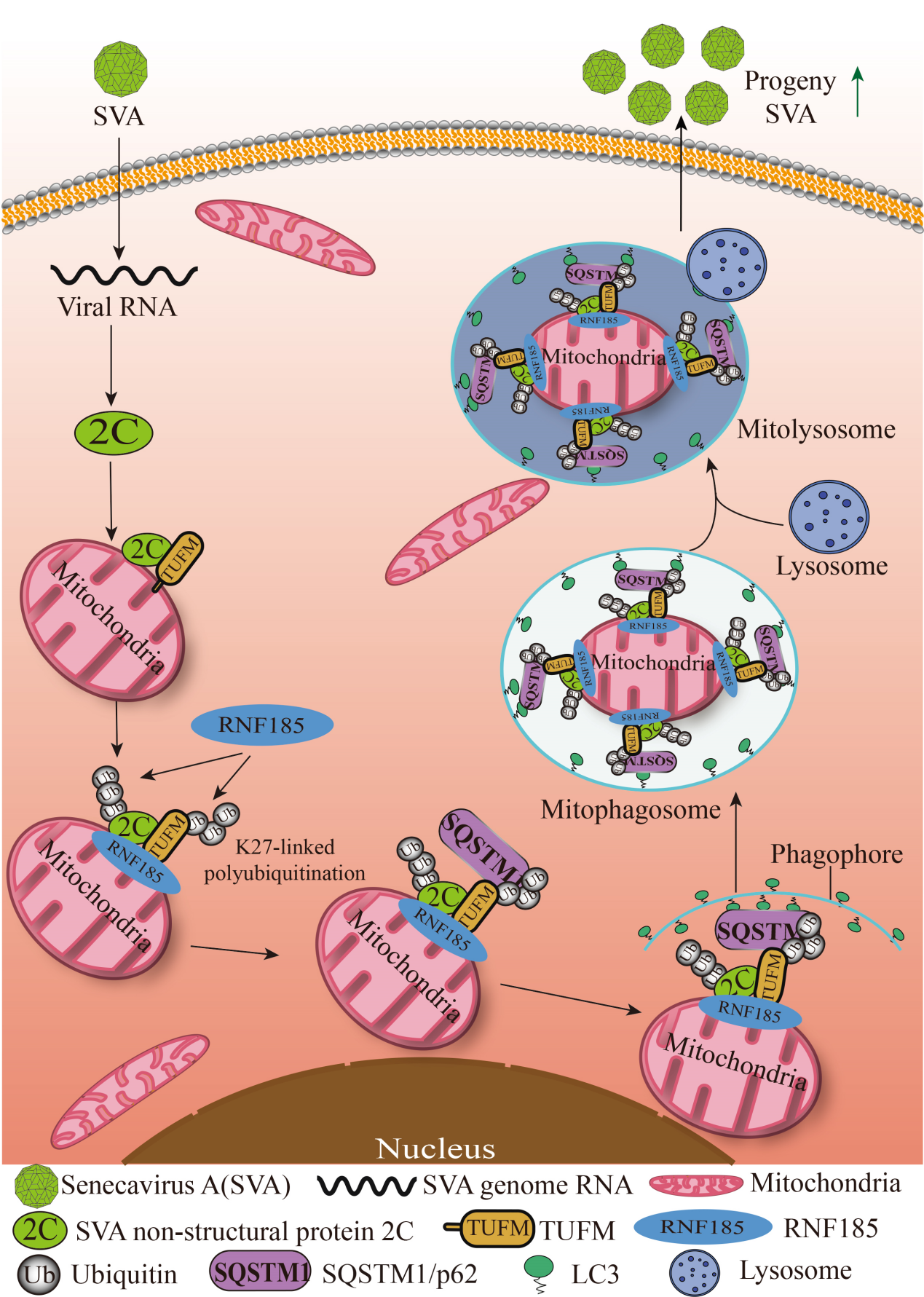
图4. SVA感染诱导细胞线粒体自噬促进自身复制的分子机制模式图
中国农业大学动物医学院张永宁副教授和杨汉春教授为文章通讯作者,博士研究生陈美荣为第一作者。该研究得到国家自然科学基金面上项目(32072840)、北京市自然科学基金面上项目(6212013)和国家现代农业产业技术体系(CARS-35)等项目的资助。
原文链接:https://doi.org/10.1080/15548627.2023.2293442
供稿:动物医学院
供图:动物医学院
编辑:李杨
责编:孟祥慈