人才强校 | 王军军教授课题组在揭示猪肠段微生物组空间异质性及其靶向定植干预规律方面取得重要进展
本网讯 我校动物科技学院王军军教授在国际知名学术期刊《Microbiome》(IF=11.607)在线发表了题为 “Spatial heterogeneity of bacterial colonization across different gut segments following inter-species microbiota transplantation” 的研究论文(https://doi.org/10.1186/s40168-020-00917-7或https://rdcu.be/caZJT)。

粪菌移植(fecal microbiota transplantation, FMT)是一种以复合菌群干预为基础的治疗手段,通过将健康供体的粪便菌群移植入患病动物或人体肠道内,达到重建受体肠道菌群、治疗和改善疾病状态的目的。FMT以其高的安全性、可靠性和治愈率引起广泛关注,逐渐成为治疗人和动物病原菌感染、坏死性结肠炎、腹泻和繁殖与呼吸综合征等疾病的常规手段。
然而,肠道微生物组在结构、功能和代谢方面呈现出明显的区室化特征,源于特定肠道生态位点的微生物可能具有靶向分区定植特性。粪便作为消化道的排泄残渣,其菌群在结构和功能上更接近后肠段,并不能完整代表整个肠道微生物区系。因此,FMT可能仅能有效改善后肠的菌群组成,而忽视小肠微生物重要的生理和营养调节功能。与传统FMT相比,使用基于空肠、回肠、盲肠、结肠等组合而成的全肠道微生物移植(Whole-intestinal microbiota transplantation, WIMT)可通过靶向重塑受体生态位点(尤其是小肠)的菌群定植,进而更好地改善机体健康和营养利用表型。
为验证上述猜想,该研究基于无菌鼠平台,首先通过将来源于猪不同肠段(空肠、回肠、盲肠、结肠)的微生物分别移植至无菌小鼠体内(图1a),通过系统分析供体与受体特定肠段微生物的组成与功能、肠道发育和基因表达,首次证实了不同肠段微生物组的靶向分区定植特性,即来源于某一特定肠段的菌群及其功能更倾向于定植在其受体的对应肠道位点(图1b)。
在此基础上,进一步比较分析了FMT与WIMT在靶向干预无菌小鼠特定肠道位置(尤其是小肠)微生物定植的效果差异(图2a)。研究结果表明FMT主要将部分外源大肠微生物移植到受体肠道,而只有极少量的外源小肠微生物被成功转移;而WIMT则更有利于将外源小肠特异性微生物及其细菌功能成功植入到受体小肠,如乳酸菌、蓝藻细菌、大肠杆菌和肠球菌等,且WIMT在促进受体小肠形态发育和降低系统炎症反应方面效果显著(图2b)。

图1
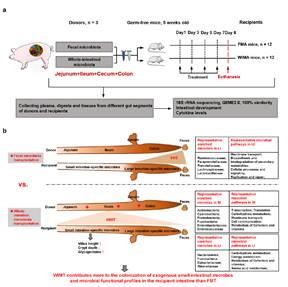
图2该研究首次阐明了猪不同肠段微生物组的空间异质性及其移植干预的分区定植规律,揭示了菌群移植重建受体肠道菌群的新机制,证实了全肠道菌群移植在调控受体小肠菌群和肠道发育特性方面比传统粪菌移植的效果更好。研究结果对使用全肠道菌群移植替代粪菌移植靶向调控人和动物特定肠道位点的微生物组成和机体健康具有引领性意义,并为精准肠道微生物组供体的开发(如肠段微生物组体外模拟培养产物)提供了新思路。
我校动物科技学院王军军教授为论文第一通讯作者,华中农业大学魏泓教授和美国阿肯色大学赵江潮副教授为论文共同通讯作者,动物科技学院2017级博士研究生李娜为论文第一作者。该工作获得了国家自然科学基金、北京市自然科学基金、111创新引智基地项目和金新农-动物科学发展基金等项目的资助。
